
単回使用医療機器の「再製造」制度が医療機器業界に与える影響
情報センサー2018年8月・9月合併号 業種別シリーズ
医療機器セクター 公認会計士 加藤 翼
主に国内事業会社の監査業務に従事。業種は、医療機器メーカーを含む製造業を中心に、小売業、ソフトウエア業、サービス業などを幅広く担当。法人内部の医療機器セクターの職員リーダーとして、セクター会議の企画・運営を行っている。
Ⅰ はじめに
2017年7月、厚生労働省より単回使用医療機器の「再製造」に関する制度の創設が公表されました。本稿では、当該制度が創設された背景および制度の概要について紹介します。
Ⅱ 再製造制度の概要
1. 制度化の背景
単回使用医療機器(SUD: Single Use Device)とは、文字通り一回限りの使用が認められている医療機器であり、一度使用したら安全性の観点から廃棄が必要とされています。SUDの中には、一点当たり数万円から数十万円もするような医療機器も含まれ、そのような高額品を一回限りの使用で廃棄することが、わが国における医療費高騰の一因となっているとされてきました。
また、再使用が禁止されているにもかかわらず、国内の一部の医療機関において、病院内で独自に洗浄・滅菌などの処理が行われ、再使用されている事例が発覚し、安全性の観点から問題視されてきました。
SUDの院内洗浄・滅菌による再使用は、不完全な処理に伴う感染リスクをはじめ、医療機器の性能・安全性を十分に保証し得ないため、行うべきではないことが世界共通の認識とされています。米国やドイツなど海外では、すでにSUDの再製造に関する制度が整備・運用されており、医療費抑制や資源の有効活用の観点から、わが国でも再製造制度の整備が望まれており、今回の制度創設に至りました。
2. 制度の概要
SUDの「再製造」とは、「医療機器製造販売業者がその責任のもとで使用済みSUDを適切に収集し、分解、洗浄、部品交換、再組立て、滅菌等の処理を行い、再び使用できるようにすること」とされています。
SUDは感染症防止等の観点から再使用が禁止されていますが、機能的には再使用可能なものもあると考えられており、今回の制度は、このようなSUDについて、一定の安全性を確保しつつ、再使用するための仕組みを法的に整備するものといえます。
わが国における制度の整備に当たっては、先行している海外の制度を参考にしています。例えば、米国では再製造SUDをオリジナル品(新品)とは別の新たな医療機器とみなし、それぞれに対し医療機器として薬事承認を要求する制度となっています。また、ドイツでは再製造に一定の規制がかかっており、病院が再製造業者と契約し、再製造業者により使用済みSUDが収集され、再製造SUDは同じ病院に納入される制度となっており、院内洗浄の延長のような形態といえます。
わが国の制度は、米国の制度を参考に、「国内の医療機関で使用されたSUDのみ」を対象とし、再製造SUDはオリジナル品とは別の医療機器として承認を必要とする制度とされました(<図1>参照)。
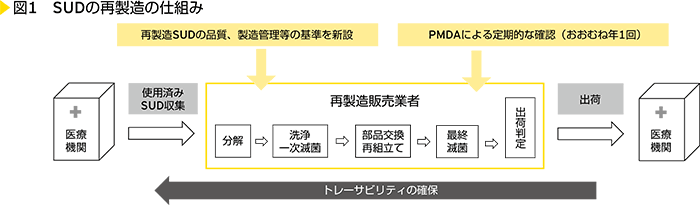
【SUD再製造制度のポイント】
- 再製造SUDを製造販売する企業は、厚生労働省の審査を受け、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器法)に基づく製造販売業許可を取得する必要がある
- 再製造SUDは、元々のSUD(オリジナル品)とは別の品目として、製造販売承認が必要となる
- 再製造SUDに係る安全対策、回収等の医薬品医療機器法上の責任は、オリジナル品メーカーではなく、再製造を行った製造販売業者が担う
- 再製造SUDの品質、製造管理、トレーサビリティの確保等に関する再製造単回使用医療機器基準(平成29年厚生労働省告示第261号)が新設されている
再製造SUDは、既存の複数回使用可能な医療機器 の洗浄・滅菌に関するガイドライン※の科学的根拠に基づき、十分な清浄性を確保していることなどを品目ごとに審査し、製造販売承認することになります。
再製造販売業者は、新設された再製造単回使用医療機器基準に基づき再製造工程を整備し、運用状況についてPMDA(独立行政法人 医薬品医療機器総合機構)による定期的な確認(おおむね年1回)を受ける必要があります。
再製造SUDにはシリアル番号が付され、使用済みSUDを回収した医療機関から、製造工程、流通までの情報のトレーサビリティを確保する必要があります。
3. 今後の課題
SUD再製造制度の導入により、医療費の削減や資源の有効活用といったメリットが享受できると考えられますが、この制度が有効に機能するためには「安全性の確保」が最重要といえます。そもそも、SUDは感染症防止等の観点から一回限りの使用が認められた医療機器であり、安全性の観点からいえば、再使用は制限されるべきとも考えられます。再製造SUDが医療機関や患者から受け入れられるためには、当該制度による十分な安全性の確保が社会的に認知される必要があります。
再製造SUDの価格はオリジナル品より安くなると考えられますが、保険制度も含め、価格設定方法等については明らかになっていません。海外ではオリジナル品の5割程度で販売されているものもあり、オリジナル品を含めた価格競争に陥る可能性があるため、新たにSUD製造・販売に参入する企業だけでなく、オリジナル品メーカーの販売戦略や業績に与える影響も大きいと考えられます。
また、オリジナル品メーカーが当該再製造に参入するか、あるいは新規企業(医療機器メーカー以外の洗浄・滅菌業者等)がどれだけ参入するかによっても、医療機器市場全体の構図が大きく変化する可能性があります。
Ⅲ おわりに
わが国におけるSUDの再製造制度では、再製造SUDの製造販売に当たって厚生労働省の承認が必要であり、前述の課題や不透明な部分も多く、実用化に至っていないのが実情です。一方で、医療費削減への期待は大きく、患者の自己負担を抑えられる可能性もあり、社会保障制度にも大きなメリットをもたらすと期待されています。
また、本制度によりSUDの安全性が確保され、患者が安心して治療を受けられる環境の構築にもつながるのではないでしょうか。
医療機関や関連する企業が、政府や自治体と連携しながら当該制度の導入に向けて取り組み、早期に実用化されることを期待しています。
※ 例:内視鏡の洗浄・消毒に関するガイドライン(第2版)(日本消化器内視鏡技師会)、鋼製小物の洗浄ガイドライン2004(日本医科器械学会)など


